【技术解析】布地格福吸入气雾剂:多孔磷脂微粒技术及DSPC的关键作用
多孔磷脂微粒技术产生背景
定量吸入器 (MDI) 是最常见的用于治疗哮喘、慢性阻塞性肺病(COPD)等呼吸道疾病的吸入疗法设备类型之一。
然而,这类药物的研发面临着诸多技术挑战,尤其是对于多联药物的混悬液型 MDI,容易受到混悬液异质性、体外药物相互作用以及患者操作的影响,这关系到药物的剂量稳定输送和肺部沉积率,进一步影响疗效。为了克服这些挑战,多孔磷脂微粒技术由此诞生。
多孔磷脂微粒技术介绍
多孔磷脂微粒技术的商业化代表性产品Breztri®(倍择瑞®令畅®布地格福吸入气雾剂)于2019年批准上市,可以同时稳定高效地递送布地奈德、格隆溴铵和福莫特罗三种药物成分,2024年其全球销售额达9.78亿美元。
所采用的专业技术平台被阿斯利康命名为共悬浮递送系统Aerosphere™,本质为采用低密度多孔磷脂微粒与药物晶体共悬浮,提高悬浮药物的稳定性和均质性,使各组分药物的剂量递送均与目标剂量一致,同时提升给药准确度与肺部沉积效率。
多孔磷脂微粒技术优势
从技术原理来看,前文提到的AerosphereTM采用的共悬浮输送技术发源自PulmoSphere™技术中的基于载体形式的多孔磷脂微粒。该多孔磷脂微粒由两种辅料DSPC (1,2-二硬脂酰-sn-甘油-3-磷脂酰胆碱, 93%, w/w)和CaCl2 (氯化钙, 7%, w/w)混合组成
- 其中DSPC作为乳化剂,在料液制备过程可形成磷脂单分子层,包裹药物与油相;
- CaCl2作为表面调节剂,其钙离子可与DSPC磷酸胆碱头部的磷酸基团作用,提高磷脂的凝胶-液晶相变温度(Tm),同时降低干燥后微粉对湿度的敏感度,增加粉体对环境的耐受性。
该低密度多孔磷脂微粒,在吸入药物的肺部递送中发挥着关键作用:
- 防止颗粒聚集:磷脂多孔微粒的表面极性与抛射剂HFA的表面极性相似,降低了多孔颗粒聚集的趋势。
- 多种药物组合稳定性:多孔微粒的两亲性波纹表面允许药物晶体和颗粒之间产生强烈且稳定的非特异性结合,且无需添加额外的助溶剂和稳定剂,避免了复杂的药物间相互作用。
- 悬浮稳定性:由于多孔颗粒的密度小于抛射剂的密度,因此多孔颗粒/药物晶体团块易分散成形成均质的悬浮液,简化给药前操作,提升了患者依从性。
- 高肺部沉积率:肺部沉积率可达48%。该多孔磷脂颗粒空气动力学粒度分布(APSD)重复性良好, MMAD(粒径中位数)约3.0 μm,为最优气动粒径,可确保最大气溶胶化,将药物有效地递送到中央和外周气道。当这些颗粒从MDI中释放出来并进入肺部后,暴露在气道温度和湿度下,多孔结构会吸收水分导致完全塌陷成粘液样结构,并与局部气道粘膜表面结合,将药物释放到粘膜表面。
- 剂量递送一致性:各种吸气流速和摇晃技术下,无论为单方、复方还是三方药物,均呈现一致的剂量,药物均等比例输出,各药物成分的 FPF(细微粒子分数) 和 MMAD 均相当。
- 气道耐受性:磷脂是肺表面活性剂的内源性成分,氯化钙也天然存在人体液中,也是因此当用于吸入药物输送时,它们具有生物相容性,并且气道耐受性良好。
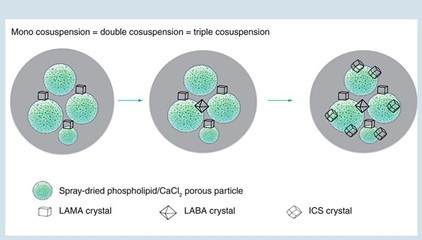
图1.磷脂微粒悬浮在推进剂液滴中与微粉化药物晶体相互作用的示意图
LAMA,长效毒蕈碱拮抗剂;LABA,长效β 2受体激动剂;ICS,吸人性糖皮质激素;
选择DSPC组成吸入制剂中的多孔磷脂微粒的原因
- 生物相容性:优异的生物相容性和安全性
- 稳定性:高相变温度(~55℃),为药物制剂提供热稳定性和氧化稳定性
- 结构完整性:作为成壳剂,在喷雾干燥过程中稳定液滴
多孔磷脂微粒工艺
该技术通过喷雾干燥含有DSPC、氯化钙、和氟碳化合物(例如全氟辛基溴化物PFOB)组成的乳液微粒来产生低密度多孔磷脂微粒,其中DSPC与氯化钙摩尔比为2:1,氟碳化合物作为致孔剂在随后步骤中被去除。
表1. PulmoSphere™多孔磷脂微粒的工艺组分
| 组分 | 化学式 | 类别 | 在制备工艺中的作用 |
| DSPC | C44H88NO8P | 辅料 | 乳化剂 |
| 氯化钙 | CaCl2 | 辅料 | 表面修饰剂 |
| 水 | H2O | 工艺助剂 | 乳液中的连续相(后续步骤去除) |
|
PFOB全氟辛基溴化物 |
C8F17Br | 工艺助剂 | 乳液中的分散油相(后续步骤去除) |
随后通过3种形式将活性药物掺入到多孔磷脂微粒中:
- 基于溶液的形式:药物简单地溶解在乳液的连续相中,并对含药物的乳液进行喷雾干燥。这通常会导致形成含有无定形药物和辅料的高度多孔复合颗粒,其中辅料组成的疏水性壳在颗粒表面富集。
- 在基于悬浮液的形式:微粉化药物颗粒悬浮在乳液进料中并喷雾干燥,从而产生涂有多孔辅料涂层的无定形或结晶药物颗粒。
- 基于载体的形式:将仅含有辅料的多孔磷脂微粒用作微粉化药物颗粒的载体。阿斯利康的AerosphereTM技术平台即是将微粉化的API晶体混悬液,在抛射剂中与喷雾干燥多孔微粒(由DSPC和氯化钙组成)共混。
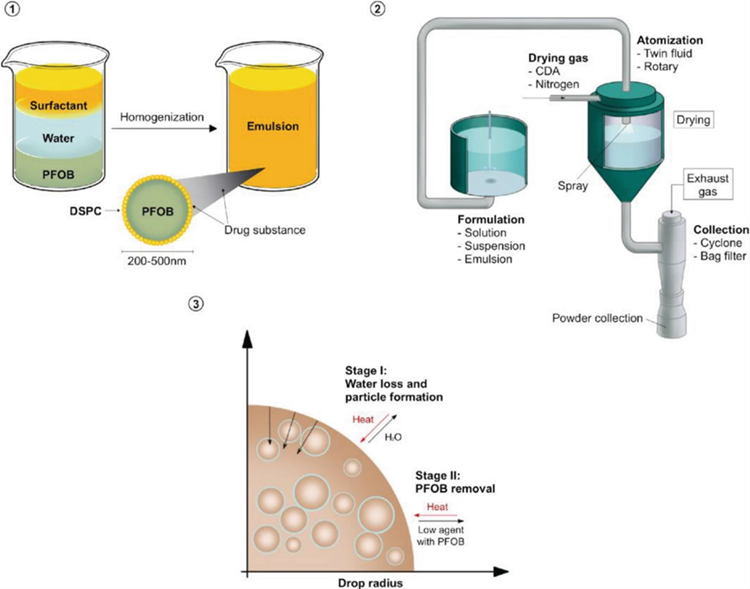
图2.采用基于乳液的喷雾干燥法制备PulmoSphere™微粒
(1) 高压均质化产生亚微米乳化液滴。(2) 喷雾干燥过程。(3) PulmoSphere™ 制剂的形成。
该技术适用于多种药物组合及各种剂量的吸入疗法,其中药物晶体与多孔磷脂颗粒共悬浮,可被开发成干粉吸入剂(DPI)、气雾剂(MDI)以及雾化吸入剂。
多孔磷脂微粒应用案例
PulmoSphere™衍生出的低密度多孔磷脂微粒技术平台,除了能够完成低剂量的复方制剂准确递送(最低剂量<1 μg),还可被用于递送高剂量的抗菌药物(最高剂量>100 mg)。
表2.基于多孔磷脂微粒技术的吸入制剂
| 商品名 | API | 剂型 | 适应症 | 原研及上市时间 | 辅料-磷脂 |
| Breztri® |
布地奈德/富马酸福莫特罗/格隆溴铵 |
吸入气雾剂 | COPD/哮喘 | AZ,2019 | DSPC |
| Bevespi ® | 格隆溴铵/富马酸福莫特罗 | 吸入气雾剂 | COPD/哮喘 | AZ,2016 | DSPC |
| Airsupra® | 布地奈德/硫酸沙丁胺醇 | 吸入气雾剂 | COPD/哮喘 | AZ,2023 | DSPC |
| TOBI ® Podhaler ® | 妥布霉素 | 吸入粉雾剂 | 囊性纤维化患者肺部感染 | Viatris,2011 | DSPC |
除了上述介绍的已上市的COPD/哮喘与肺部感染疾病适应症,目前多孔磷脂微粒技术也在不断拓展新的适应症例如肺动脉高压、特发性肺纤维化,以及其他API如环丙沙星、两性霉素B、醋酸奥曲肽、地塞米松、前列环素类似物QCC374等。
Croda禾大Avanti™ DSPC
Croda禾大,致力于高纯度辅料的研发,助力药物高效递送。
Croda禾大Avanti™,专注脂质研发及商业化50多年,可提供高纯度多孔磷脂微粒技术的核心辅料DSPC。为积极响应客户的需求,我们的Avanti™ GMP 结构脂质,已拓展至韩国。
| 产品名称 | 化学名称 | 产地 | 登记情况 |
| Avanti™ DSPC | 1,2-二硬脂酰-sn-甘油-3-磷酸胆碱 | 美国 |
DMF已登记 CDE:F20220000181(I) |
| Avanti™ DSPC | 1,2-二硬脂酰-sn-甘油-3-磷酸胆碱 | 韩国 |
DMF已登记 CDE:申请中 |
产品核心优势
- 合规保障:严格符合 USP 专论的质量规范要求
- 品质可靠:经第三方验证的一致性、安全性及药用级品质
- 注册便捷:简化含 USP 合规 DSPC 成分的药品注册流程
- 供应链安全:覆盖全球的脂质生产基地,统一质控体系,均遵循cGMP标准,EXCiPACT认证。
Croda 禾大吸入制剂辅料解决方案
Croda禾大专注药用辅料研发,拥有十年的辅料生产与纯化经验,提高药物活性成分在制剂中的稳定性,最终实现改善药物疗效、延长保质期和成功投放市场。
我们为吸入制剂药物的开发,提供优质高纯度药用辅料,可优化多种活性成分的递送效果。
- 提升MDI(定量吸入器)、雾化及软雾制剂的活性成分溶解度
- 稳定吸入制剂的化学与物理性质
- 改善干粉吸入制剂的颗粒形成与递送效率
| 产品名称 | 化学名称 | 登记情况 | 上市产品 |
| Avanti™ DPPC | 二棕榈酸磷脂酰胆碱 | DMF 已登记 |
Arikayce®阿米卡星吸入脂质体混悬液 Inbrija®左旋多巴吸入干粉 |
| Avanti™ DPC | 十二烷基磷酸胆碱 |
DMF 已登记 CDE:F20220000056 (A)
|
Baqsimi® 胰高血糖素鼻用粉雾剂 |
此外,我们也提供一系列高纯度辅料如DDM(十二烷基-β-D-麦芽糖苷)、胆固醇、聚山梨酯80、聚山梨酯20、司盘20、油酸、丙二醇、PEG400、苯甲醇、甘油等。
下一期我们将解析禾大此类辅料产品的在吸入制剂中的广泛应用场景与独特优势。
参考文献
[1].Spray-Dried PulmoSphere™ Formulations for Inhalation Comprising Crystalline Drug Particles. AAPS PharmSciTech. 2019 Feb 7;20(3):103.
[2].Novel cosuspension metered-dose inhalers for the combination therapy of chronic obstructive pulmonary disease and asthma. Future Med Chem. 2011 Oct;3(13):1703-18.
[3].Inhalation powder development without carrier: How to engineer ultra-flying microparticles? Eur J Pharm Biopharm. 2023 Oct;191:26-35.
[4].Porous Particle Technology: Novel Approaches to Deep Lung Delivery. In: Mehta, P.P., Dhapte -Pawar, V. (eds) Pulmonary Drug Delivery Systems: Material and Technological Advances. Springer, Singapore.
GMP脂质产品目录
用于肺部给药系统的高纯度药用辅料

.jpg&mn=healthcare&w=768&xr=0&yr=0&xfp=6&yfp=6&hash=EFBFE4284D9BC021F8E2BDF9F2D50E6EC48FD48282C5F620)
.jpg&mn=healthcare&w=768&xr=0&yr=0&xfp=6&yfp=6&hash=BB6BEB25A58C0C099D8DB244A4FAE779C48FD48282C5F620)