核酸递送中的靶向脂质纳米颗粒
什么是靶向脂质纳米颗粒?
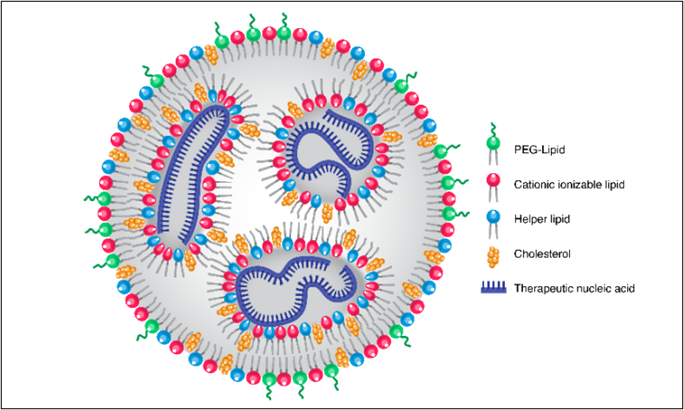
脂质纳米颗粒(LNPs)是由胆固醇、辅助脂质、聚乙二醇(PEG)脂质和可电离脂质等脂质组成的先进药物递送系统。这些组分形成了一个稳定的、生物相容的载体,可以封装和保护核酸如mRNA和siRNA,确保它们有效递送到目标细胞进行基因表达或沉默。"靶向"的方面涉及使用配体或抗体修饰这些纳米颗粒,以特异性地结合到目标细胞上的受体,确保精确递送。LNP是目前最有效和先进的非病毒核酸递送平台。
LNP的演变
LNP的旅程始于将裸露的mRNA直接肌肉注射到小鼠体内,这项技术由于核酸的大尺寸、极性和不稳定性而显示出有限的效力。LNP的引入通过增强核酸的稳定性和细胞摄取来解决这些挑战。如今,LNP已成为核酸递送的黄金标准,有几种FDA批准的应用,包括COVID-19 mRNA疫苗和遗传性淀粉样变性的治疗。
LNP的化学原理
LNP是通过酒精稀释的过程来配制的,其中核酸分散在水性缓冲液中,脂质溶解在酒精中。这种混合物通过微流控混合迅速结合形成纳米颗粒来封装核酸。靶向LNP通过加入靶向配体或修改脂质组成进一步细化,以增强对所需组织或细胞的特异性。
靶向机制
LNP可以被动或主动地靶向特定组织。
被动靶向依赖于纳米颗粒的物理化学性质,如大小和电荷。例如,较小且带负电的LNP更有效地被淋巴结树突状细胞摄取,因而适合疫苗递送。
LNP的大小可以通过调整脂质如DMG-PEG2000的摩尔量来进行调节。通过将DMG-PEG2000的量从0.004微摩尔增加到0.12微摩尔,可以使LNP的大小从200纳米减少到30纳米,显著增强淋巴结中CD+树突状细胞的细胞摄取。
被动靶向利用增强的渗透和保留(EPR)效应,这在靶向肿瘤时特别有用。肿瘤组织通常具有渗漏的血管和不良的淋巴引流,允许纳米颗粒在肿瘤组织中比在正常组织中积累更多。此外,LNPs的表面电荷和亲水性可以调整,以增强它们与特定细胞类型或组织的相互作用,提高它们在所需位置的摄取和保留。
主动或配体介导的靶向,则涉及在LNP表面添加特定的配体或抗体。这些配体与目标细胞上的受体结合,确保精确递送。例如,甘露糖偶联的LNP已被证明可以增强树突状细胞的摄取,增强疫苗应用中的免疫反应。
使用DSPE-PEG2000-马来酰亚胺,一种聚乙二醇化的脂质,作为将抗体或靶向配体连接到LNP表面的连接物,实现了LNP的主动靶向。DSPE-PEG2000-马来酰亚胺使抗体如抗CD4和PECAM-1的偶联成为可能,促进了对T细胞和肺血管内皮细胞的靶向递送。这种方法提高了LNP递送的特异性和效率,减少了非靶向效应,改善了治疗效果。利用DSPE-PEG2000-马来酰亚胺,研究人员可以设计LNP,以精确递送到各种组织,扩大在肿瘤学和神经学等领域的应用。
克服肝脏趋向性
LNP的一个挑战是它们自然倾向于在肝脏中积累,主要是由于肝细胞通过清除受体介导的摄取。虽然这对于治疗肝脏疾病是有益的,但它限制了LNP在非肝脏目标的应用。研究人员已经开发了克服这一挑战的策略,例如改变LNP的表面电荷和组成,或使用"纳米引物"暂时阻止肝脏摄取,从而增强对其他组织的递送。
在癌症治疗中的应用
脂质纳米颗粒在肿瘤学中具有巨大的前景,特别是用于递送基于mRNA的癌症疫苗和免疫疗法。BioNTech和Moderna等公司正在这一领域开创先河,目前有几种mRNA癌症疫苗正在进行临床试验。这些疫苗旨在激活免疫系统对抗肿瘤特异性抗原,为癌症治疗提供了一种新方法。
扩展肝脏以外的应用
tLNPs的潜在应用远远超出了肝脏疾病的范围。例如,人们正在探索将tLNPs靶向递送到肺部,这可能会彻底改变囊性纤维化和流感等呼吸系统疾病的治疗。同样,将LNP靶向到中枢神经系统(CNS),通过克服血脑屏障,可以为治疗神经退行性疾病提供新的途径。此外,tLNPs正在被用于递送CRISPR-Cas9组分,为疾病细胞中的精确基因编辑提供了可能性。
结论和未来方向
靶向脂质纳米颗粒代表了药物递送领域的创新进展,有潜力改变各种疾病的治疗。未来的研究可能会集中在提高tLNPs的特异性和效率,以及探索不同医疗领域的新应用。随着技术的不断发展,tLNPs可能很快成为个性化医疗的基石,提供针对个体患者需求量身定制的靶向和有效治疗。
靶向脂质纳米颗粒(tLNPs)的开发和完善对于推进医学科学和改善患者结果至关重要。在这一领域的持续研究和创新有望开启新的治疗可能性,以解决未满足的医疗需求。
Croda Avanti 致力于研究高纯度脂质产品,通过不断创新,不断拓展和丰富脂质产品组合,希望可以助力您的项目研究进展,给您带来不一样的创新体验。
使用Avanti的DSPE-PEG2000-maleimide,革新配体介导的靶向,提升您的脂质纳米颗粒性能。